Poruchy acidobazické rovnováhy
Acidobazická rovnováha a její poruchy. Diagnostika poruch ABR, hodnocení vyšetření podle Astrupa. Interpretace vyšetření ABR je demonstrovaná na čtyřech kazuistikách. Jako poruchy acidobázické rovnováhy (ABR) označujeme stavy, kdy
pH vnitřního prostředí je odchýleno od normy (acidémie, alkalémie) nebo v organismu je přebytek nebo nedostatek kyselin či bází, tj. dochází ke změně složení pufrů (které může a nemusí být doprovázeno změnou výsledného pH; acidóza, alkalóza). Kurz je určen studentům lékařské biochemie a biochemie.
klíč k zápisu je "biochemie"
Optické metody používané v biochemii

Text vysvětluje principy a použití optických metod v lékařské biochemii. Podrobněji se zabývá fotometrií a spektrofotometrií, dále se probírá nefelometrie a turbidimetrie, fluorimetrie a spektrofluorimetrie, luminimetrie, polarimetrie a další.
Elektrochemie
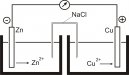
Text vysvětluje základy elektrochemie pro lékařskou chemii a biochemii. Zabývá se elektrodovými ději a vznikem elektrického článku, iontově selektivními elektrodami, potenciometrií. Podrobněji je pojednáno měření pH skleněnou elektrodou. Stručně popisuje elektrolýzu a polarografii.
Návody k praktickým cvičením z lékařské chemie a biochemie, letní semestr

Návody k praktickým cvičením z lékařské chemie a biochemie pro 2. ročník oboru lékařství, letní semestr, vyučovaným na Ústavu lékařské biochemie. Elektronický výukový dokument je dostupný na e-learningovém serververu 1. lékařské fkulty Univerzity Karlovy v Praze studentům oborů lékařské chemie a biochemie.
Chemické výpočty on-line
Materiál slouží jako doplněk k seminářům z lékařské chemie a biochemie pro posluchače 2. ročníku lékařství. Obsahuje příklady zaměřené především na výpočty koncentrací, stechiometrické výpočty a výpočty pH silných a slabých kyselin a bazí a pufrů. Systém automaticky kontroluje odpovědi.
Iontová síla

Přednáška vysvětluje iontovou sílu jako míru odlišnosti reálného a ideálního roztoku. Uvádí definici této veličiny, příklady výpočtů. Přednáška je doplněna krátkým testem. veličina charakterisující celkovou „koncentraci náboje” v roztoku, , kde ci je koncentrace jednotlivých iontů a Zi jejich náboj. Iontová síla roztoku ovlivňuje aktivitní koeficienty jednotlivých iontů (Debyeův-Hűckelův zákon) a tím i všechny veličiny, které závisejí na aktivitě (např. pH roztoku, rovnovážnou konstantu, změnu Gibbsovy energie při reakcích apod.). Protože iontová síla biologicky významných roztoků je relativně vysoká, je ji nutno brát v úvahu při všech výpočtech, kde se vyskytuje aktivita iontů a nespoléhat se na oblíbené konstatování, že „koncentrace látek v roztoku je nízká a místo aktivit můžeme použít koncentrace”.
Úloha ATP v metabolismu
Úloha ATP v metabolismu. Prezentace z přednášky pro 2. roč. lékařství. Úloha ATP v metabolismu. Prezentace z přednášky pro 2. roč. lékařství. Úloha ATP v metabolismu. Prezentace z přednášky pro 2. roč. lékařství. Úloha ATP v metabolismu. Prezentace z přednášky pro 2. roč. lékařství.
Návody k praktickým cvičením z molekulární biologie

Návody k praktickým cvičením z molekulární biologie pro studenty 2. ročníku oboru lékařství. Molekulární biologie je vědní disciplína zabývající se studiem buněčných biologických procesů na jejich molekulární úrovni. Podstata některých biologických jevů jako například dědičnosti je odhalitelná pouze studiem jejich molekulární podstaty. Molekulární biologie se proto věnuje popisu biologických makromolekul a jejich vzájemným funkčním vztahům. Zvláštní pozornost je především věnována funkci makromolekul podílejících se na dědičnosti organizmů, tedy DNA, RNA a proteinům, jejich vzájemné interakci a regulaci jejich funkce (Ve zkratce zjednodušeně: „DNA → RNA → protein“.)